Também reforçam a importância de manuseio adequado para obter dados úteis.O ensaio ocorreu em sistema de recirculação (RAS, “recirculating aquaculture system”) com 36 tanques de 600 L. A água manteve parâmetros adequados para a espécie. Em 23 de maio de 2024, os animais foram distribuídos: controle (n = 10) e três grupos experimentais (10 por grupo; n = 30). Adultos (26,18 ± 0,84 g) foram fotografados e, depois, confinados por 3 h em gaiolas com alta densidade. O grupo controle retornou ao tanque de aclimatação no mesmo período.
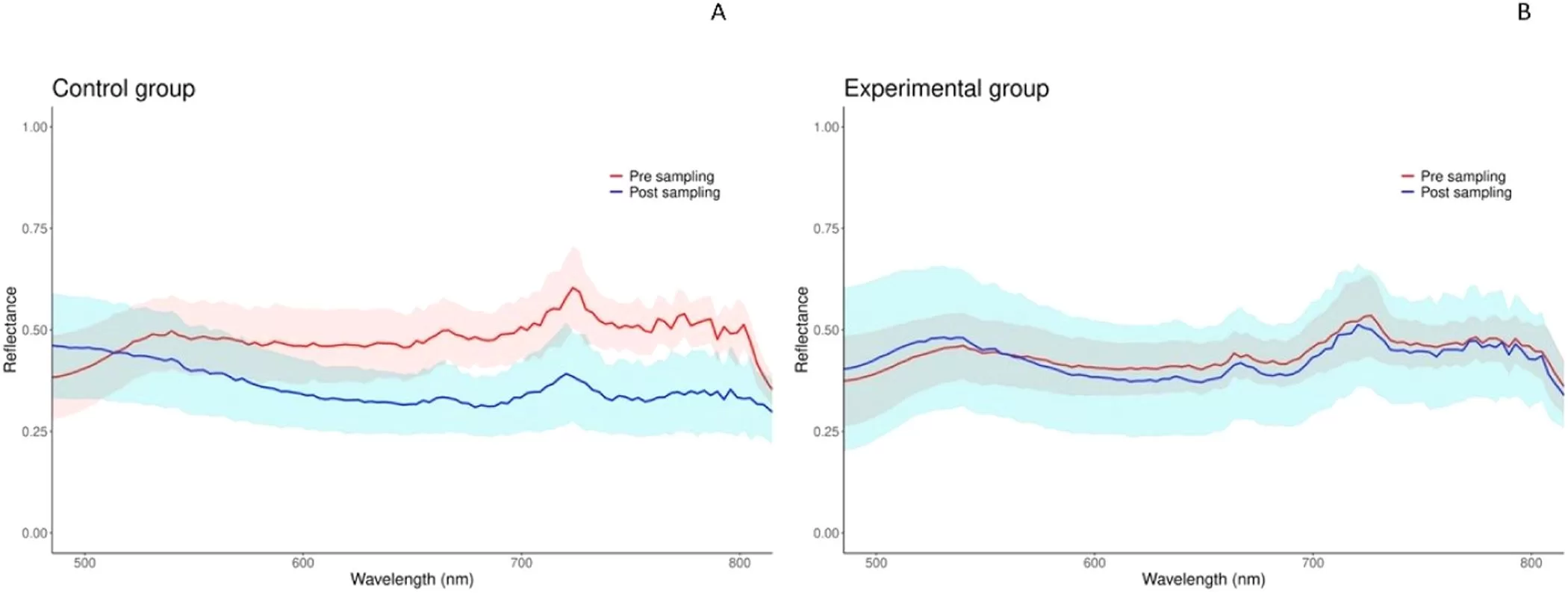
A instrumentação usou LED azul real (~445 nm) e câmera DSLR com filtro amarelo para bloquear reflexos. A equipe aplicou uma câmera hiperespectral Specim IQ (faixa VNIR, “visível-infravermelho próximo”, 400–1000 nm; resolução espectral 7 nm; 512 pixels espaciais; 360 ms de exposição). Os dados foram segmentados no software Breeze. As regiões de interesse (ROI) verdes foram extraídas pela razão 535/650 nm (>1,2; mínimo de 4 pixels). O canal 535 nm serviu como índice de fluorescência.
Resultados principais
No controle, a fluorescência caiu mais de duas desvios-padrão após 3 h em baixa densidade. Nos grupos experimentais, as respostas divergiram: um grupo espelhou a queda do controle; outro manteve o espectro; o terceiro elevou a intensidade. Todos exibiram, no pré, pico vermelho ~700–730 nm. As áreas fluorescentes também mudaram entre pré e pós, com aumentos claros no controle e no grupo 1.
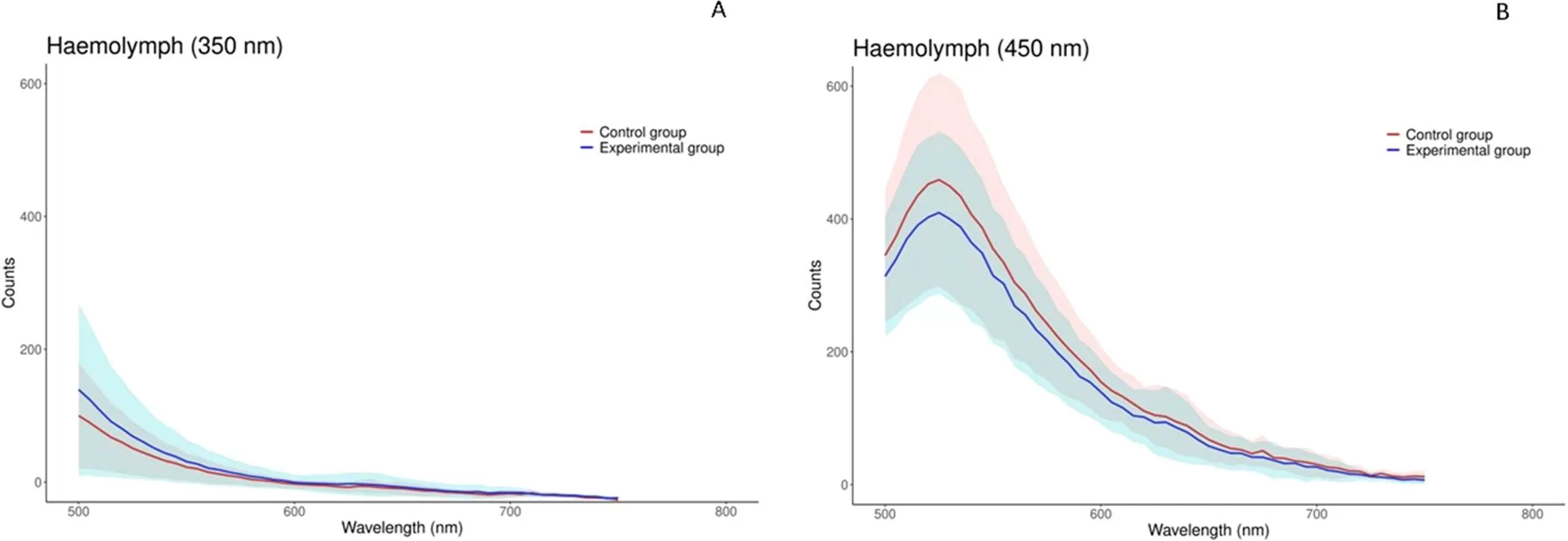
A hemolinfa (fluido circulatório) mostrou alta variabilidade individual. Em 350 nm de excitação, o controle teve menor radiância que os experimentais; em 450 nm, ocorreu o oposto. Não houve relação clara entre a fluorescência externa e a da hemolinfa no nível de grupo.
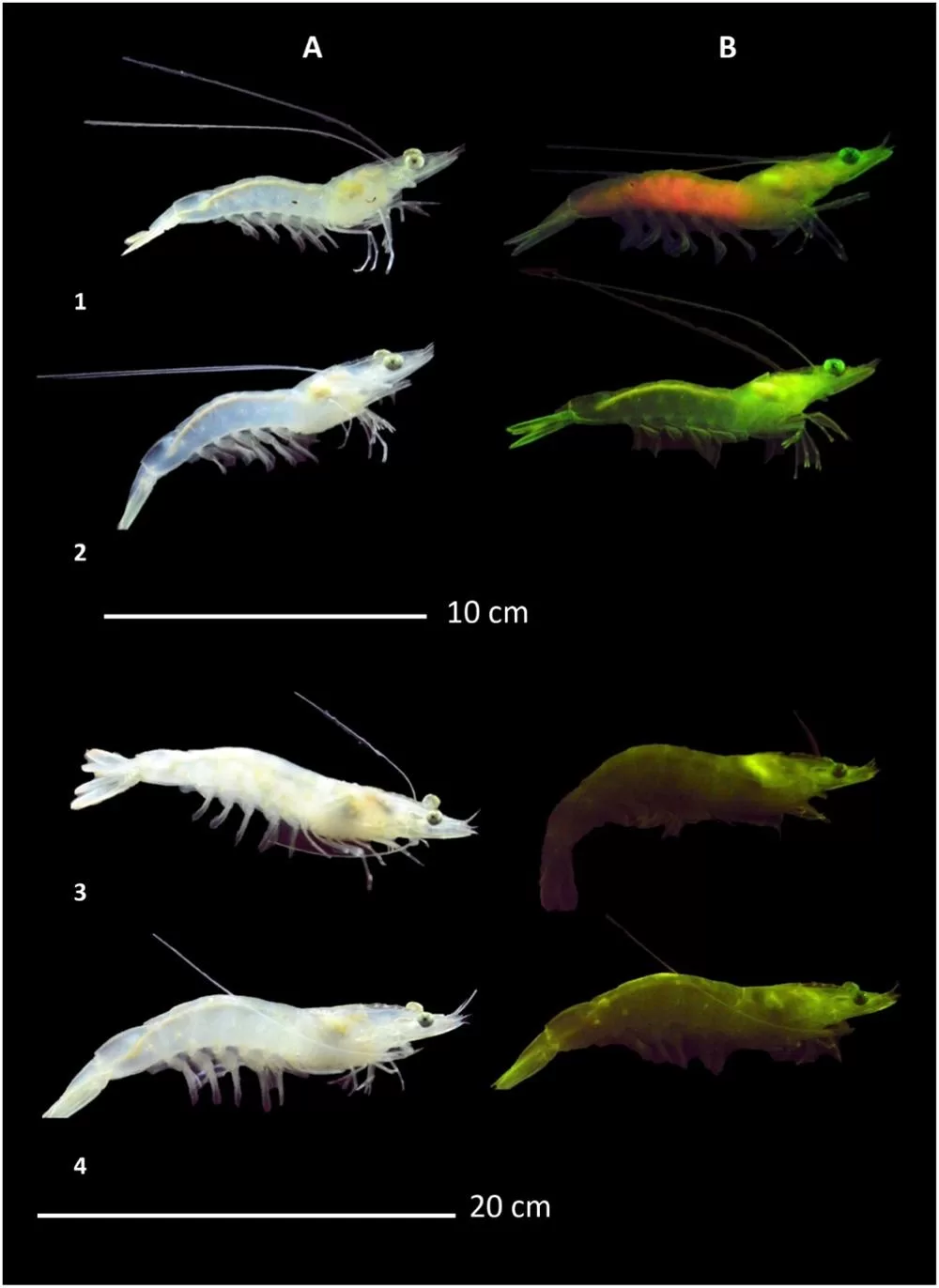
As imagens confirmaram o padrão óptico do estudo: rampa verde seguida de pico vermelho. Juvenis exibiram, em geral, fluorescência verde; um indivíduo mostrou componente vermelho abdominal, validado pela câmera hiperespectral.
O trabalho é exploratório. A equipe optou por estatística descritiva (médias, desvio-padrão e box plots). Não aplicou testes inferenciais, pois as “features” de imagem ainda estão em desenvolvimento para a espécie.
O que fica para a aquicultura
A biofluorescência do L. vannamei é dinâmica e sensível a estressores de manejo e densidade. O método, baseado em imagem hiperespectral e índices simples (razão 535/650 nm), desponta como ferramenta de monitoramento não invasivo. Próximos passos incluem estabelecer perfis-base e avançar para aplicações em tempo real nas granjas.



























